2018年兽药质量监督抽检和风险监测计划
根据《兽药管理条例》规定,为做好2018年兽药质量监督抽检和风险监测工作,充分发挥兽药质量监督效能,特制定本计划。
一、职责分工
各省级兽医行政管理部门要按照本计划要求和《2018年兽药质量监督抽检和风险监测数量汇总表》(附录1)确定的检测任务,结合本辖区兽药管理工作实际,制定辖区兽药质量监督抽检和风险监测计划,辖区计划监督抽检数量不得低于本计划下达的监督抽检数量。兽医行政管理部门与兽药检验机构配合,承担本计划的抽样工作,并负责对监督抽检不合格的企业进行查处,具体实施部门可根据各省(自治区、直辖市)的管理方式进行调整。
中国兽医药品监察所(以下简称“中监所”)和省级兽药检验机构承担本计划的检验工作。
二、抽检和监测原则
兽药质量监督抽检和风险监测要遵循突出重点、强化预警、固本清源、扶优打劣的原则,重点抽检和监测兽药生产经营问题较多、诚信较差企业的产品,加大对兽药经营、使用环节的抽检和监测力度。原则上对每个标称生产企业抽检和监测批数累计不超过本年度总批数的1%。重点加大近年来没有实施抽检的企业产品抽检力度,本年度内各省(自治区、直辖市)原则上应对本
辖区所有兽药生产企业至少实施1次监督抽检。
要注意合理配置检验资源,减少同时符合以下标准的企业的产品抽检和监测比例,其产品由中监所进行监督抽检:①近3年被抽检兽药产品批数超过100批;②合格率大于99%(含99%);③产品不确认率小于2%(含2%);④风险监测未发现质量安全隐患;⑤无农业部公告第2071号规定情形等违反兽药管理规定的各项情形;⑥2017年已列入近3年监督抽检数量较多且合格率较高企业名单的,除监督抽检总批数外,其他条件均满足的继续保留。具体见“近3年抽检批数多且合格率较高的企业名单”(附录2)
三、抽检和监测比例
(一)品种比例
各地抽检和监测的水产、蚕、蜂用兽药产品批数应占总数的5%~20%,上述产品的主产区、主销区以及用量较大的地区可增加抽检和监测比例;兽用抗菌药抽检和监测比例不得低于40%。
(二)抽检和监测类别及比例
1.监督抽检。从生产、经营环节抽取样品,原则上生产环节、经营环节按3∶7比例进行,辖区内生产企业在20家以下的,上述比例可适当调整。监督抽检重点是2017年监督抽检不合格的产品(见2017年质量通报)、重点监控企业产品以及回函不确认产品较多的企业(附录3)产品、近3年未被抽检兽药生产企业的产品、新建或新增剂型兽药生产企业的产品,其抽检批次应不少于全年抽检批次的40%;进口兽药产品应有一定比例,进口口岸以及用量较大的地区抽检比例不得低于5%。2018年兽药监督抽检指定兽药品种(附录4)的抽检批次应不少于全年抽检批次的20%。
2.风险监测。从使用环节抽取样品,中药、化学药品各半,其中抗寄生虫类药物和中药类散剂等兽药产品应占风险监测抽检批次的40%以上,对可能存在的非法添加物进行全面筛查、确认,以掌握兽药质量的真实情况。
(三)兽用生物制品的监督抽检。强制免疫用疫苗全部从经营和使用环节抽检,其他兽用生物制品亦应尽量增加经营使用环节抽样比例,重点抽检近5年未被抽检企业的产品、未开展过监督检验的品种、涉嫌违法改变制苗菌(毒)种以及列入监督抽检通报的产品,包括进口兽用生物制品。加强禽用活疫苗外源病毒检验。进一步增加抽检批数,对所有兽用生物制品品种逐步做到全覆盖。
四、抽样要求
(一)监督检查
1.在监督抽检和风险监测中均坚持抽样和监督检查相结合,抽样时对被抽样单位实施监督检查。
2.发现列入我部发布的禁止使用的药品和化合物清单(禁用兽药清单)的产品、标准已经废止的产品、未经我部批准的产品、过期失效产品、改变标准或改变处方产品、近两年列入我部发布的兽药质量通报同一批号的假劣产品,以及2017年被通报为非法企业(附录5)的所有产品,由兽医行政管理部门依法实施收缴销毁,立案查处,不再进行抽样。
3.2016年7月1日起生产的、未赋二维码的兽药产品,依据《兽药管理条例》《兽药标签和说明书管理办法》等有关规定进行处理,不再进行抽样。
对现场发现的上述违法情况、发现的假兽药或其他违法违规行为,地方兽医行政管理部门要按照《兽药管理条例》和《农业行政处罚程序规定》,依法及时查处并汇总到省级兽医行政管理部门,按季度报送我部兽医局进行通报。
(二)抽样
1.监督检验抽样活动要严格执行《兽药质量监督抽样规定》(农业部令2001年第6号)。风险监测抽样样品数量可适当减少,满足检验和留样需要即可。抽样程序均应符合规定,抽样单填报信息要完整,抽样时要核对产品贮存要求和实际存储条件、清点所抽取产品的库存数量,并在抽样单上标注贮存条件和数量。从经营、使用环节抽样时,抽样前应对抽取样品来源和购销情况进行现场核实。核实内容包括:二维码追溯情况、购买方式、供货单位、人员和联系电话、进货时间、进货数量等,上述内容应在抽样单上标注,并经双方签字认可。同时,应收集购货发票复印件等相关购货凭证留存备查。
2.对2017年度经生产企业确认非该企业产品累计3批以上、且企业确认非该企业产品占被抽检产品总批数75%以上的兽药经营企业(附录6)要列为重点监督检查单位,并加大对其经营产品的抽检比例。
五、检验要求
(一)监督抽检
1.各地应遵循当季抽样、当季完成检验和按时上报结果的工作原则,不得采取集中抽取样品,分次检验和上报结果的工作方式,并注意保证产品的贮存条件和有效期满足检验、复检要求。
2.各兽药检验机构根据产品情况确定合理的检测项目,对兽药国家标准规定了鉴别、有关物质和含量测定项的产品,原则上应对鉴别、有关物质和含量测定项全部进行检验,并上报结果。中监所负责组织承担单位进行检测项目的能力验证考核。
3.检验结果不符合兽药国家标准的,涉嫌改变处方添加其他药物成分的、含量无法测定的以及添加违禁药物的样品判定为不合格,并在上报结果时标明相关信息。省级兽药检验机构发现的无法出具检测报告、无法确证的,送中监所进行确证检验并出具检验报告。
(二)风险监测
风险监测样品由各兽药检验机构抽取,应遵循当季抽样、当季完成检验和按时上报结果的工作原则,实施风险物质筛查或按我部兽医局要求开展重点项目质量监测。风险监测结果仅用于对使用环节的兽药质量情况进行风险预警,为制定兽药质量监管措施提供技术依据。针对监测不合格的情形,检验机构要及时报告省级兽医行政管理部门,必要时实施跟踪监督抽检。发现新的尚无检测方法的非法添加药物时,兽药检验机构要第一时间报告我部兽医局和中监所,中监所要组织有关单位开展补充检查方法制定和复核工作。
(三)对非法添加其他药物成分的检验
应当执行农业部公告第2353号、第2395号、第2448号、第2451号、第2571号等农业部发布的补充检查方法。对于没有补充检查方法的,可按《兽药中非法添加物质检查方法标准》(附录7)自行建立补充检查方法。使用补充检查方法所得出的监督检验结果,可以作为兽药监督管理部门认定兽药质量的依据。兽药检验机构遇到对添加其他药物成分的兽药产品难以进行确认时,可将样品送中监所进行检验。
六、监督抽检结果处理
(一)报告发送和复检
经营环节监督抽检的产品经检验不合格时,兽药检验机构应以快递方式或直接送达方式向被抽样单位所在地省级兽医行政管理部门和标称生产企业所在地省级兽医行政管理部门发出检验报告,标称生产企业所在地省级兽医行政管理部门应在收到检验报告后3个工作日内将不合格检验报告转交标称生产企业,并留存凭证。生产环节监督抽检的产品经检验不合格时,兽药检验机构应以快递方式或直接送达方式向被抽样单位和生产企业所在地省
级兽医行政管理部门发出检验报告,并留存凭证。
标称生产企业/生产企业对检验结果有异议的,应当在收到检验结果之日起7个工作日内,向原检验单位申请复检,并说明复检理由。未按时提出异议的,视为认可检验结果。原检验单位认为复检理由合理的,应进行复检。标称生产企业对复检结果仍有异议的,可自收到复检结果之日起7个工作日内向我部提出复检申请。对于合理的申请,我部指定复检单位,复检样品由原检验单位提供(应为抽样留存样品)。
(二)结果处理
1.被抽样单位的处理
生产、经营企业所在地省级兽医行政管理部门在收到监督抽检不合格检验结果报告后应及时按照抽样单上标注的库存数量,对被抽样单位依法实施查处,清缴销毁库存产品,责令停止生产经营、召回售出产品,监督销毁并依法实施立案处罚;经企业所在地省级兽医管理部门和经营许可证发证部门审核认为整改合格后,方可恢复生产经营。
2.标称生产企业的处理
对经营环节监督抽检样品,标称生产企业所在地省级兽医行政管理部门收到不合格检验结果报告后,应及时开展调查核实。
标称生产企业对产品真实性有异议的,可以向所在地省级兽医行政管理部门提出,由所在地省级兽医行政管理部门对生产销售情况进行调查核实,并将情况通报被抽样单位所在地省级兽医行政管理部门。被抽样单位省级兽医行政管理部门接到对不合格产品真实性异议的通报后,要立即立案调查,追溯产品来源,对确属于标称生产企业的,由相关省级兽医行政管理部门对标称生产企业从重处罚。
标称生产企业对产品真实性无异议的,企业所在地省级兽医行政管理部门应及时组织查处,责令停止生产、召回售出产品,监督销毁库存产品和召回产品,并依法实施立案处罚;经企业所在地省级兽医行政管理部门审核认为整改合格后,方可恢复生产。
3.依法从重处罚
按照农业部公告2071号规定,对符合从重处罚的情形,依法予以从重处罚,应当启动吊销兽药生产许可证、经营许可证以及撤销兽药产品批准文号程序,严肃查处。
七、重点监控企业判定原则及处罚措施
(一)判定原则
符合下列条件之一的均列入本年度重点监控企业。
1.当期兽药质量通报产品涉嫌违法添加其他药物成分的;
2.当期兽药质量通报产品含量低于50%(含50%)或高于150%(含150%)的;
3.全年兽药质量通报产品含量低于80%(含80%)或高于120%(含120%)累计2批次以上的;
4.全年兽药质量通报中同一企业被抽检产品不合格批次超过10%(含10%)的
(二)监控措施
为严厉打击生产假劣兽药违法活动,加大兽药质量监管力度,2018年度被通报为重点监控的企业,在省级兽医主管部门未完成立案查处、未提交企业整改报告、未提交假劣兽药收回销毁记录前,不受理其兽药生产许可证、产品批准文号等行政许可申请,不安排兽药GMP检查验收;被两次通报为重点监控的企业,视情节严重程度和飞行检查情况,采取收回《兽药GMP证书》、吊销《兽药生产许可证》和撤销兽药产品批准文号等行政处罚措施,并在1年内不受理该企业所有兽药行政许可申请;对连续两次抽检不合格的产品,将依法撤销该产品批准文号,并在3年内不受理该产品批准文号申请。
八、工作要求
(一)兽药监督抽检和风险监测结果实行季报制度,各省级兽药检验机构应于每季度后5个工作日内按规定格式分别向本辖区省级兽医行政管理部门、我部兽医局和中监所上报抽检监测结果(水产、蚕、蜂用兽药需另行标注)。中监所应于每季度后20日内将抽检监测结果汇总表、质量分析报告报我部兽医局。
(二)各地要建立完善兽药质量跟踪监督制度,对抽检不合格的兽药,生产企业所在地省级兽医行政管理部门应对该企业同品种不同批号及其他产品进行跟踪抽检3批。在对生产该不合格兽药的生产企业跟踪时,对该品种1年以上暂不生产的,有关生产企业应当提供书面说明;当该品种恢复生产时,必须书面报告
所在地省级兽医行政管理部门和兽药检验机构,对恢复生产后的前3批进行跟踪抽检。各省应将跟踪抽检结果单独报送我部兽医局和中监所,并按季度将跟踪抽检纳入监督抽检和风险监测不合格产品汇总上报。
(三)省级兽医行政管理部门要加强本辖区兽药违法案件查处工作的监督指导,要结合日常监管,对被通报的假劣产品组织开展清查收缴工作,并立案排查、捣毁非法生产窝点。
(四)依照《兽药管理条例》等法律法规规定,我部下达的兽药监督抽检和风险监测计划所需工作经费由中央财政支付,各地下达的本辖区兽药监督抽检和风险监测计划所需工作经费应列入当地财政预算。
附录:1.2018年兽药质量监督抽检和风险监测数量汇总表
2.近3年抽检批数多且合格率较高的企业名单
3.2017年回函不确认产品较多的企业名单
4.2018年监督抽检指定兽药品种
5.2017年被通报的非法企业名单
6.重点监督检查兽药经营企业名单
7.兽药中非法添加物质检查方法标准
8.2018年X季度兽药质量监督抽检和风险监测结果汇总表
附录1
2018年兽药质量监督抽检和风险监测数量汇总表
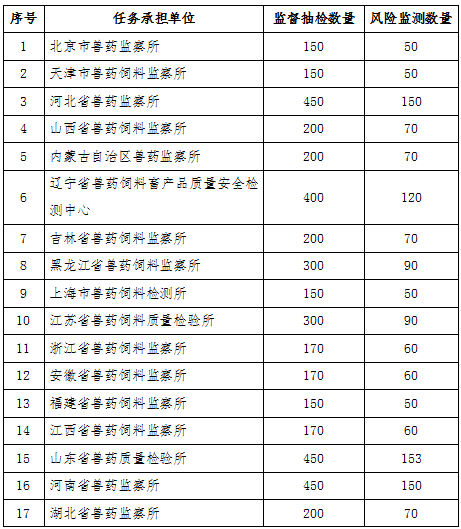
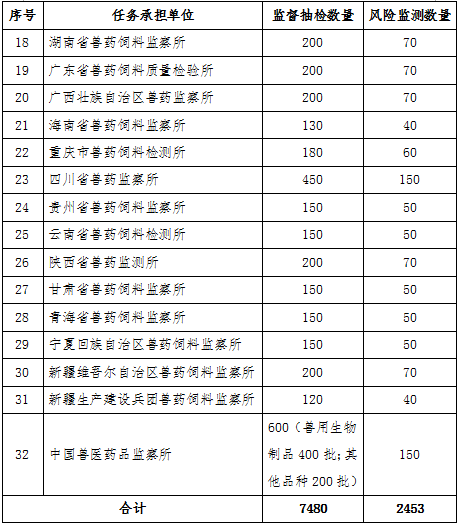
附录2
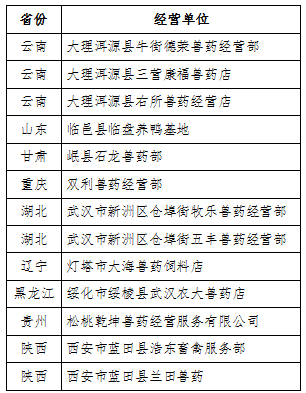
近3年抽检批数多且合格率较高的企业名单
![ILUFED10])0)B]N{(5`WIBU.png ILUFED10])0)B]N{(5`WIBU.png](http://52swine.com/data/upload/ueditor/20180205/5a77f4357de29.png)
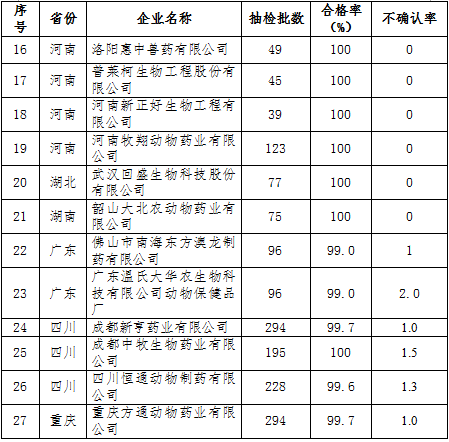
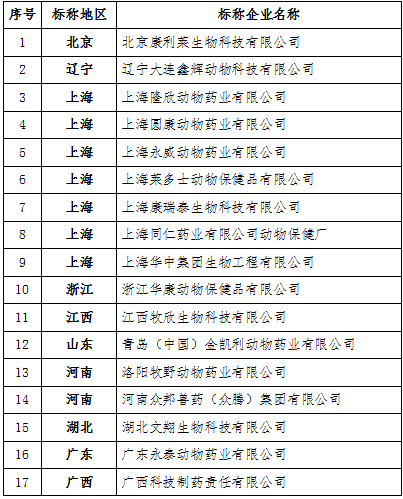
附录3
2017年回函不确认产品较多的企业

附录4
2018年兽药监督抽检指定兽药品种

附录5
2017年被通报的非法企业名单

附录6
重点监督检查兽药经营单位
附录7
兽药中非法添加物质检查方法标准
无适用的已发布兽药中非法添加物质检查方法标准时使用本标准,本标准执行前应进行耐用性验证,仅限用于建立方法的实验室,其他实验室使用时应重新进行耐用性验证。本标准执行时,应同时进行试剂空白和样品空白与阳性对照试验,检验报告应给出检出限。
第一法 液相色谱-二极管阵列法
色谱条件与系统适用性试验 根据可疑添加物性质,参照药品国家标准、兽药国家标准或者兽药残留检测方法标准的条件自建。
对照品溶液的制备 精密称取目标对照品适量,用甲醇或其他适宜溶剂配制成每1ml中含对照品10μg至50μg的溶液。
供试品溶液的制备 固体制剂需研细,称取细粉适量(如约相当于一头动物一次用量);用甲醇或其他适宜溶剂(超声)定量溶解,滤过,即得;液体制剂直接精密量取或称取适量,稀释,即得。对于含有高浓度的有机盐和乳化剂等存在强烈的基质效应辅料的产品,应适当增加前处理步骤。
测定法 分别精密吸取上述两种溶液适量注入液相色谱仪,同时记录色谱图与光谱图;通过与对照品液相色谱图保留时间、光谱图的比对,确定供试品溶液中是否含有可疑添加物。
结果判定 在供试品和对照品浓度接近的情况下,供试品色谱图中如出现与对照品峰保留时间一致的色谱图(差异不大于±5%);在
一定的波长范围内,两者光谱图无明显差异;最大吸收波长一致(差异不大于±2nm),判为检出非法添加物。
第二法 液相色谱-高分辨质谱法
液质联用条件 根据可疑添加物性质自建,采用全扫描方式采集一级质谱和二级质谱信息。
对照品溶液的制备 精密称取目标对照品适量,用甲醇或其他适宜溶剂配制成每1ml中含对照品50ng至500ng的溶液。
供试品溶液的制备 同第一法。
测定法 分别精密吸取上述两种溶液适量注入液相色谱仪-串联质谱仪,记录液相色谱图及一级质谱图与二级质谱图;通过与对照品溶液色谱图保留时间、质谱图的对比,确定供试品溶液中是否含有可疑添加物。
结果判定 方法1 供试品色谱图中如出现与对照品峰保留时间一致的色谱峰(保留时间相对偏差不大于2.5%);供试品质谱图应与对照品质谱图一致(包括分子离子和至少一个碎片离子,质量数差异小于等于5ppm),判为检出非法添加物。
方法2 供试品与对照品分子离子峰的质量数偏差不大于5ppm,且二级质谱图与对照品的二级质谱图一致,判为检出非法添加物。
第三法 液相色谱法-串联质谱法
液质联用条件 根据可疑添加物性质自建,采用离子扫描(SRM)或多反应监测(MRM)。定性离子对选用兽药残留检测方法标准中的定性离子对或者符合至少4个(非禁用药3个)识别点数的要求。
对照品溶液的制备、供试品溶液的制备 同第二法。
测定法 分别精密吸取上述两种溶液适量注入液相色谱-串联质谱仪,记录特征离子质量色谱图;通过与对照品溶液色谱图保留时间、离子丰度比的对比,确定供试品溶液中是否含有可疑添加物。
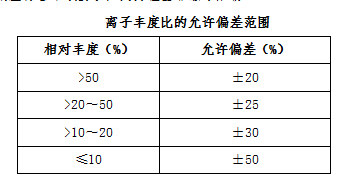
结果判定 供试品色谱图中如出现与对照品峰保留时间一致的色谱峰(差异不大于±2.5%);供试品离子丰度比应与对照品的一致,容许偏差符合下表要求,判为检出非法添加物。
离子丰度比的允许偏差范围
第四法 显微鉴别法
适用范围 适用于不含矿物药的中兽药散剂中非法添加化学成分的检查。
显微操作 照兽药国家标准中的规定操作,共制样片5片,置显微镜下观察。
结果判定 每片均检出非处方晶片,且多见,判为不符合规定。










