猪伪狂犬病(Pseudorabies, PR)是由伪狂犬病病毒(Pseudorabies virus, PRV)引起的家畜和多种野生动物的急性、热性传染病,感染谱广,不同日龄猪均可感染,可造成极大的经济损失,以发热、奇痒及脑脊髓炎为特征。
一、PRV的流行现状
在我国,PRV最早于1947年在猫中检测到。到1980年时,PRV已经在我国很多地方检测到(图1)。到2001时,在国内绝大多数省市的猪只中PRV的检测率增高,还可以在其他动物比如牛、羊、猫、狗和水貂等动物中检测到(表1)。20世纪90年代,我国PR达到发病高峰。
2000到2011年间,因为疫苗免疫防控,PR得到了较好的控制。2011至2013年间,变异PRV导致我国猪PR的新一轮暴发和再度流行,在我国很多省市暴发(图2),甚至是很多免疫过PR疫苗的猪场,给养猪业造成巨大的损失。通过各种防控措施和免疫防控方法的使用,2014年至今,PR处于平稳阶段,尽管有些地方还是有疫情报道。变异PRV毒株引起的PR的重新暴发,提醒我们提高警惕,加强PRV的临床监控,研究变异PRV毒株的特性,研制针对变异PRV毒株的综合防控措施。
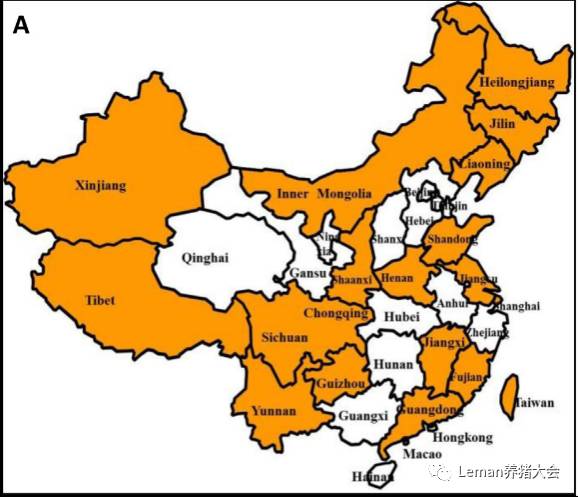
图1. 1980年前我国经典PRV感染的地理分布(Sun et al., 2016)
表1. 我国经典PRV毒株感染的地理分布和报道年份(Sun et al., 2016)

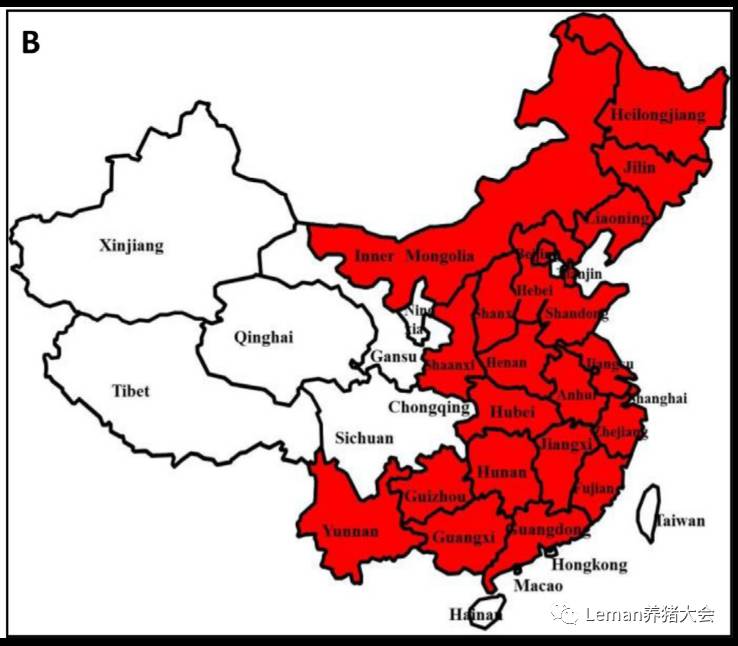
图2. 2011年后我国变异PRV感染的地理分布(Sun et al., 2016)
二、导致猪伪狂犬病病毒新毒株出现的原因和新PRV毒株gC基因的遗传进化特点
长期使用伪狂犬病疫苗,可能导致了PRV毒株的变异;猪场种猪群带毒,PRV毒株在不断的感染进化过程中;猪场不能实施净化,无法根除PRV;阳性猪场(带毒种猪)长期免疫——因免疫压力造成病毒的变异。
新PRV毒株gC基因的遗传进化特点如图3所示,表明我国变异PRV毒株和马来西亚PRV毒株构成了独立的基因二型。而目前为止,其他国家的PRV毒株处于基因一型中。表明本次我国变异PRV毒株的独特性。
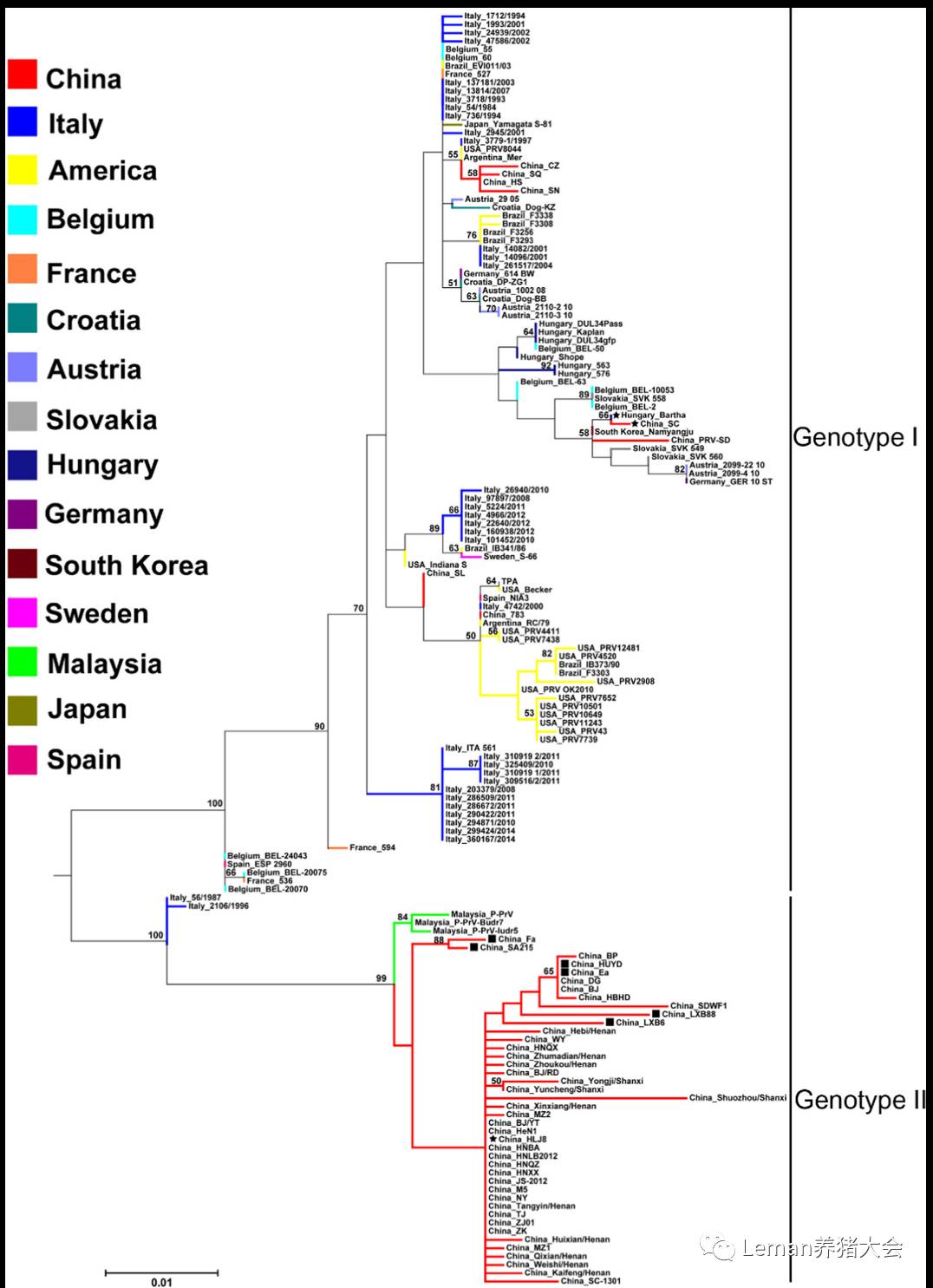
图3. 来自不同国家PRV毒株的gC基因的遗传进化特点(Ye et al., 2016)
三、PRV主要传播途径
水平传播:
(1)空气传播:从育肥猪经空气传入(2-3km),是目前大多数伪狂犬病发生猪场的风险点。需要监测90日龄以后猪的伪狂犬病gE抗体;
(2)引入潜伏感染猪;
(3)引入带毒公猪精液;
(4)(蓝耳病)血清人工驯化技术的风险;
垂直传播:
胎盘传播;其他动物传播途径:a:鼠类(如果在猪场周围发现鼠和猫死亡数量高于平时,需要注意伪狂犬病传入的风险(1985年爱尔兰案例);
b:野猪: 8498个样本,2009-2012。35个州中有25个18%以上抗体呈阳性(Kerri Pedersen ,2013)。
四、主要诊断方法
1980年前主要的鉴定方法是病毒分离、病毒中和实验和动物感染实验。从19世纪90年代后,ELISA、PCR和定量PCR被广泛用于PRV的鉴定。因为检测机构众多,商品检测ELISA试剂盒也很多,目前还没有统一标准的鉴定方法。
依据gB/gE的ELISA方法被广泛运用,其中依据gB建立的ELISA主要用于评估疫苗免疫的免疫水平,依据gE建立的ELISA方法主要用于鉴别诊断感染猪只和疫苗免疫猪只。
现在很多分子诊断计数,比如PCR,定量PCR,环介导等温扩增,已经可以对野毒感染毒株和疫苗毒株进行区分。现在针对新毒株的检测和与经典PRV毒株以及疫苗PRV毒株的鉴别诊断技术已经建立(Meng et al., 2016)。临床实践中,对不同毒株的鉴别诊断对疾病的评估,后期防控措施的制定十分重要。
五、防控方法
A:伪狂犬病阴性猪场和尚未受到伪狂犬病病毒新毒株感染的猪场:加强生物安全措施,严防新毒株的传入;引种监测;人员进出控制;运输工具的清洗消毒和灭鼠等;
B:强化疫苗免疫接种:变异PRV毒株在很多免疫过经典PRV毒株来源的疫苗的猪场中依然引起发病,变异PRV来源的基因修饰疫苗对变异PRV感染引起的PR有较好的效果,而且便于与临床感染毒株的鉴别诊断(表2),不同毒株来源疫苗之间的交叉保护性还不确切,因此在选择疫苗毒株之前,需要对临床PRV感染毒株进行鉴别诊断。后备猪应在配种前进行2次伪狂犬病疫苗的免疫接种;经产母猪产前4周左右进行1次免疫;仔猪8-10周龄进行1次免疫;母猪群普免2-3次/年、仔猪滴鼻免疫;
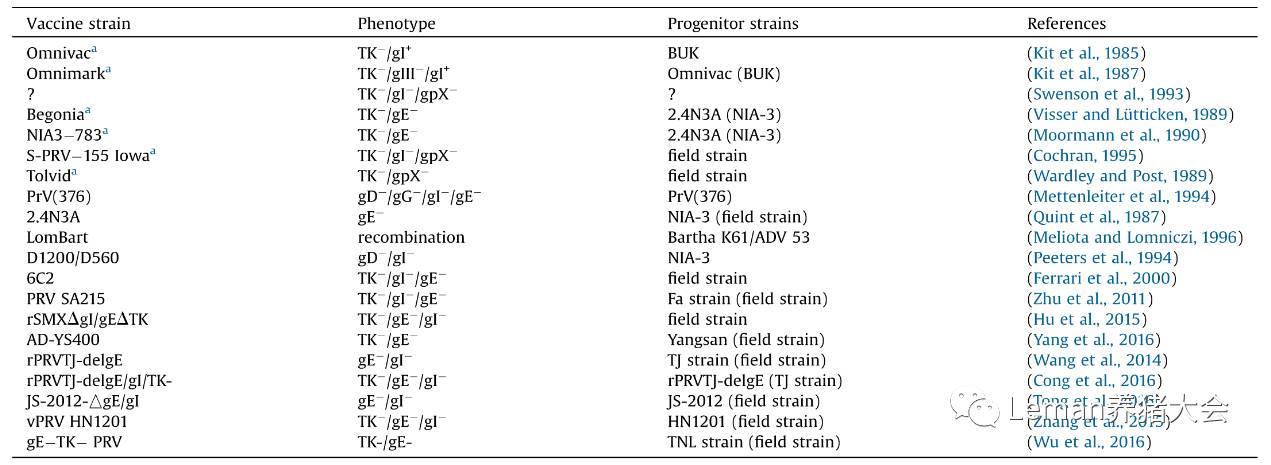
表2 用于免疫的基因修饰PRV毒株(Freuling et al.,2016)
C:感染猪场(种猪场):在做好疫苗免疫接种的基础上,开展净化工作;加强后备种猪的监测,用阴性后备种猪逐步替换和淘汰阳性种猪,最终建立阴性种猪群,达到阴性种猪场的标准。
净化是控制猪伪狂犬病的唯一出路:
净化的条件:基因缺失疫苗(gE缺失);gE-ELISA抗体检测试剂盒;
净化的基本技术:免疫——gE基因缺失疫苗;监测——gE-ELISA检测种猪群(gE抗体阳性种猪);淘汰——清除gE抗体阳性种猪;替换——引入gE抗体阴性后备种猪;清群——清除gE抗体阳性种猪群、PRV感染猪群
净化阶段与过程:
第一阶段:监测——种猪群感染带毒状况调查。依据种猪群大小和规模,按5%-10%进行采样,确定种猪群带毒率(gE抗体阳性率);
第二阶段:强化免疫,gE基因缺失疫苗免疫,生物安全;
第三阶段:检测淘汰——全群检测,逐头采样,用gE-ELISA试剂盒。若种猪群带毒率<>
第四阶段:部分清群,若种猪群带毒率>10%或15%,进行全群检测,记录阳性种猪;实施部分清群;淘汰高胎次阳性种猪,用阴性后备种猪替换高胎次种猪。
第五阶段:监测与维持,种猪群全群采样进行检测,确认全部为阴性,无阳性带毒种猪;设立哨兵猪——在种猪舍放置PRV抗体阴性仔猪,观察是否感染和发病,检测gE抗体,确认为阴性;加强引种监测,禁止引入阳性带毒种猪;加强生物安全措施。达到免疫无疫(猪场无PRV)以及后面的停止疫苗免疫,不免疫无疫。
本文主要编译于何启盖教授和杨汉春教授在2015年和2016年李曼中国养猪大会的演讲报告及相关参考文献资料。
编译:陈芳洲
审阅:刘爱民博士










