体外受精(In Vitro Fertilization,IVF)是借助人工操作让精子和卵子在体外环境中完成受精过程的一项技术。IVF 技术可以给动物繁殖提供数量更多、成本更低的胚胎,不仅能开发优良母畜的繁殖潜力,同时加速了良种公畜的育种进程。然而IVF 技术中用于体外受精精子的保存条件难以控制。若保存条件不佳,精子的质量就会下降,从而导致受精率降低以及胚胎发育不良。
例如,环境中活性氧(ROS)含量持续升高会产生氧化应激(Oxidative Stress,OS),精子在这种条件下保存就可能导致其质量下降。雄性生殖器官的新陈代谢是处于不断产生的ROS 条件下,在交配过程中精子也必经过高氧环境,因此,为了保护雄性生殖能力,必须重视氧化应激保护机制。睾丸组织自身含有抗氧化酶体系,并且它们是清除ROS 的主力军,因此,精子在生物体内几乎不受到OS。但是在体外环境中,由于温度和光照等因素,使精子容易遭受OS。因此,要在家畜生产上提高IVF 效率,首先要解决精子在体外环境中的氧化损伤,本文将从以下几个方面进行综述。
一、精子与氧化应激作用
1、 ROS 及其对精子的有益作用
ROS 是指生物体内含氧且具有较强氧化还原活性的自由基和非自由基氧的衍生物。ROS 是生物正常有氧代谢过程中产生的一系列副产物,主要包括超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(OH-)、一氧化氮(NO-) 等。因为核外有未配对的电子存在,所以具有很强的化学反应活性。在精子结构和功能成熟的生理过程中,ROS 的生成是有益的。如图1 所示,ROS(主要是H2O2)是通过催化磷酸酯酶的氧化灭活来控制高活性半胱氨酸巯基(Cys-SH)的催化中心,进一步保证细胞的连续增殖,由于体内研究数据的逐渐积累, 表明相同的机制也可能适用于生殖系统中。由此可知,ROS 信号转导可能有助于维持精子体内的稳态,还能促进精子发生细胞的生长。此外,精子在体外保存过程中,呼吸代谢产生的少量而持续的ROS 可以诱发精子超激活运动并获能, 参与相关的酪氨酸磷酸化活动,并且ROS 水平的变化还能调节细胞凋亡和精子获能2 个过程之间的平衡。
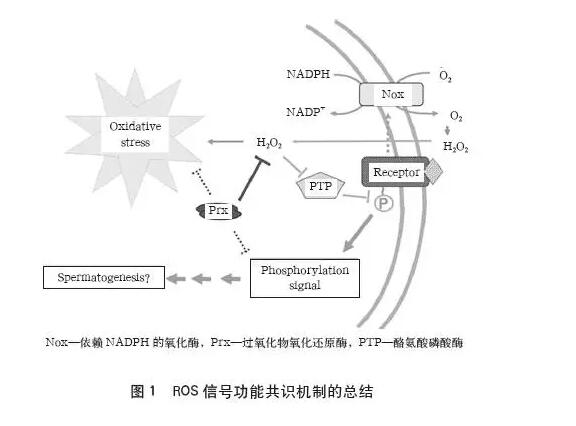
2、 OS 对精子的危害
精子离开体内的抗氧化系统后,精子体内代谢机制异常,ROS 水平会不断上升,其氧化速度超过氧化物的清除速度,导致氧化- 还原体系失衡,最终造成精子遭受OS。OS 是由ROS 生产不平衡造成的,即细胞内氧化和抗氧化系统之间的稳态被破坏。ROS 不仅能减少抗氧化酶的活性,还能损伤线粒体DNA(mtDNA)。mtDNA 是线粒体膜的电子传递链上必不可少的一种多肽, 密切参与线粒体的氧化磷酸化和ATP 的生成,因此mtDNA 缺陷将导致线粒体膜电位下降,从而使氧化还原平衡更趋向于OS,最终,对精子造成不可逆的伤害。OS 会损伤精子发生的细胞、精子发生的过程以及精子功能。OS 对精子发生细胞最直接的危害是破坏其内部结构,现在已有20 多种不同类型的结构损伤已被确认(图2)。精子发生对温度十分敏感,因此热休克蛋白(HSP70)与哺乳动物精子生成密切相关,有研究表明,OS 会影响精子发生过程中HSP70 的表达。ROS 浓度超标会干扰精子的代谢,导致多不饱和脂肪酸质膜发生脂质过氧化,进而降低精子能动性;还会影响精子的受精能力,具体表现为顶体反应能力下降。
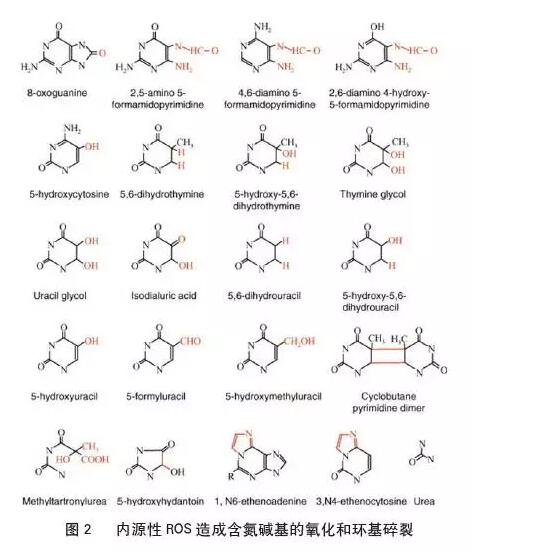
二、 精子的抗氧化原理
在体内,精子本身具有氧化还原能力,例如, 能量供应和氧化还原电位对维持液态保存精液中的精子功能是必不可少的。有研究表明,哺乳动物的精子通过糖酵解、糖酵解结合线粒体三羧酸循环或三羧酸循环结合磷酸戊糖途径获得的能量均可使精子产生极大的氧化还原能力。但Qiu 等研究发现,在维持山羊精子运动性时,磷酸戊糖途径比糖酵解更重要,因为磷酸戊糖途径可以减少精子OS 并为糖酵解提供更多的中间产物。此外,还有报道证明,通过柠檬酸循环获得能量能维持牛精子的运动性,但对小鼠精子无影响。精子自身还能修复ROS 的损伤,主要包括脂肪酶、蛋白酶及其他酶类对损伤分子进行修复。但有研究表明,只有当ROS 对精子DNA 造成的损伤程度轻时,其自身修复功能才会自动开启。
在动物体内生殖组织中也存在氧化- 还原平衡体系,受到ROS 刺激时抗氧化机制就会被启动,降低精子受到氧化损伤的程度。哺乳动物体内进化出几种减少氧化应激和降低ROS 损伤的抗氧化机制(图3):一个是由酶和低分子量化合物(如维生素) 组成的抗氧化系统,这个系统在有害ROS 有机会接触其他重要分子并终止后续连锁反应之前将其清除;另一个是氧化还原系统,这个系统不仅能清除有害氧化物,还能不断地恢复已氧化的分子。精子发生过程中新陈代谢高度活跃,这表明生殖系统本身就能产生高水平的ROS。因此在生殖道上皮细胞和睾丸支持细胞上经常出现高含量水平的氧化还原分子,如AKR(Aldo-Keto Reductases)是醛- 酮还原酶, 能减轻羰基化合物产生的氧化应激。
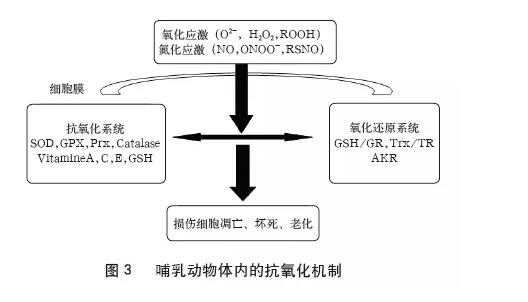
三、抗氧化剂对精子的影响
抗氧化剂主要是消除或减弱ROS 对精子的刺激,通过阻止自由基链的生成和蔓延来减少OS 造成的损伤。选用抗氧化剂时要考虑不能完全清除ROS,为防止细胞受到氧化压力,就要维持细胞内正常生理水平的ROS。
1、 提高精液质量
液态保存法常用于精子生理结构特殊的动物精液的储存。例如,猪精液常采用液态保存法,原因是猪精子质膜上不饱和脂肪酸含量高,对温度变化极为敏感,若温度降低直接会影响精子的质量,因此冷冻保存不能满足对猪受精质量的要求。然而,在液态保存条件下,精子易受到OS。针对这一问题:
刘亚伟做了相关实验,用α- 硫辛酸、维生素-P 和L- 肉碱3 种抗氧化剂对液态保存的精液进行处理,结果发现3 种抗氧化剂均能不同程度地提高精液的活率、活力、顶体完整性、质膜完整率和线粒体活性等指标,还降低脂质过氧化水平。
许春荣等发现,0.01 mmol/L 褪黑素可以提高猪精液液态保存后的品质,1 mmol/L 多巴胺有利于猪精子的液态保存。
Eslami 等研究了公羊精液的液态保存,发现棕榈油酸可以作为一种抗氧化剂来保护精子免受损伤,用它处理72 h 可以显著提高精子的活力和运动能力,并且通过PCR 测定进一步证明榈油酸可以提高精子的抗氧化水平及超氧化物歧化酶(SOD)活性。
通常各类保存的精液冷冻- 解冻后质量都会下降,包括活率和活力的降低以及精子DNA 完整性的破坏。因此,经冷冻- 解冻后的精液也需要抗氧化剂的保护来提高精液质量。
2、 延长精子的寿命
精液稀释液可以维持精子在体外保存过程中的受精能力并延长其存活时间,根据用途和性质可分为现用稀释液、常温稀释液、低温稀释液和冷冻保存稀释液4 种。在稀释液中添加抗氧化剂可提高稀释液对精子的抗氧化保护能力。
3、 提高精子受精率
受精率的高低取决于精液的质量,而精子质量的评估指标之一是精子DNA 碎片指数(DNA Fragmentation Index,DFI)。DFI 是代表精子DNA 损伤程度的参数,它受ROS 和抗氧化剂之间平衡的影响。在精子总碱性磷酸酶(TALP) 介质中加入10 μg/mL 氯化锌、500 μg/mL D- 天冬氨酸盐(D-Asp)和40 μg/mL 辅酶Q10,可以有效防止精子能动性的损失,降低DFI,此外,在精液中添加这些抗氧化剂可以提高精子受精率,并使受精后胚胎的囊胚发育率显著高于对照组。抗氧化剂的确可以提高精子的受精率,但是只有添加适当的剂量才能发挥其作用。白藜芦醇(Res)和儿茶素-3- 没食子酸酶(EGCG)是2 种具有高水平抗氧化活性的抗氧化剂。
4、 提高胚胎发育效率
要保证体外受精的精子免受氧化损伤,目前研究中常采用添加抗氧化剂来达到此目标。例如超氧化物歧化酶模拟剂(MnTE) 具有抗氧化作用,这种抗氧化剂可通过细胞的渗透行为来保护精子免受ROS 诱导的基因组DNA 损伤。
四、结 语
近年来,动物繁殖率日益下降,虽已有大量关于提高精子性能的研究及改进措施,但精子的氧化现象仍很严峻,需要继续进行精子抗氧化方面的研究。目前,在畜牧业中,最简单有效的解决办法就是使用抗氧化剂。确定氧化应激的诱因及其作用机制,才能合理选择抗氧化剂种类并更好地利用其来改善精子的抗氧化损伤,提高体外受精的成功率。











手机号登录 第三方账号登录:QQ微信微博已有2条评论